Física/Termodinámica/Primeira lei/Termoquímica
A termoquímica
[editar]É a aplicación da primeira lei ás reacións químicas isotermas e isóbaras. O fundamento da termoquímica é a ecuación , que fornece unha función de estado ligada á enerxía do sistema e mensurábel experimentalmente. É graza ás propiedades de función de estado de ou H que non é necesario medir as calores de reacción de todas as reacións posibles. Como H depende só dos estados inicial e final, poderemos calcular para calquera reacción, simplemente montando un camiño composto de etapas elementais para as cales a mudanza de entalpía é coñecida.
Exemplo: procurar a mudanza de asociada á transformación . É inútil medila se coñecemos xa as calores de . En efecto, como H é unha función de estado, ten o mesmo valor cá transformación de A en C, estea efectuada directamente ou pasando polo intermediario B:
Noutras palabras, a mudanza de entalpía durante un proceso cíclico, por exemplo é nulo, os estados inicías e finais sendo os mesmos:
Para H, como para calquera función de estado:

Para poder determinar a entalpía de calquera reacción, basta de ter unha colectánea de para reaccións elementais. Foron escollidas as reacións de formación das moléculas.
Definicións
[editar]‘‘Entalpía de formación dun composto’‘: É a calor liberada ou absorbida,, cando un mol do composto se forma a partir dos elementos a presión constante.
‘‘Estado’‘ : é o estado estábel baixo 1 bar. Anotado polo expoñente º.
‘‘Entalpía de formación padrón’‘: É a calor liberada ou absorbida,, cando hai formación dun mol do composto, baixo 1 bar e a 298K a partir dos elementos nos seus estados padróns.

Por consecuencia, a entalpía padrón de formación dos elementos é nula por definición. As seguintes reacións son exemplos de reacións de formación padróns:
Lei de Hese
[editar]Se coñecermos as entalpías padróns de formación de todos os corpos que interven nunha reacción química, podemos calcular a entalpía desta reacción. Por exemplo, para calcular a entalpía da reacción :
a 25°C baixo 1 bar, a partir das entalpías padrións de formación de e a 25ºC, basta construír o seguinte ciclo:
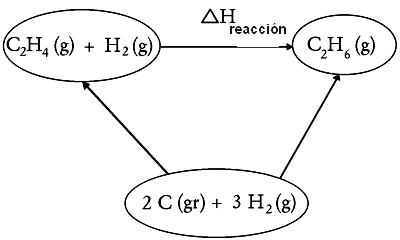
Como H é unha función de estado:
‘‘‘É a formalización da lei de Hess ‘‘‘
Efecto da temperatura sobre as entalpías de reacción.
[editar]Sexa unha reacción química:
cuxo é a entalpía a unha temperatura T. Podemos construír o seguinte ciclo:
En consecuencia:
Entalpía de combustión
[editar]Poucas reacións de formación poden ser directamente estudadas para medir as súas entalpías. Ao contrarío, podemos medir facilmente a calor liberada durante a combustán de case todos os compostos. As entalpías de formación citadas nas táboas calculáronse a partir dos valores das entalpías padróns de combustán. Por definición, a entalpía de combustán padrón 25°C é a calor liberada a 25°C baixo presión de 1 bar constante durante a oxidación completa do composto en H2O (l), CO2 (g), SO2 (g), e N2 (g). Experimentalmente, medimos a calor de combustán en presencía dun exceso de osíxeno, nunha bomba calorimétrica, que é un recipiente illado con volume constante e resistante á presión.
As reacións de combustán están tamén na orixe das chamas. Estas constitúen un medio de reacción cuxo tamaño se limita non polas paredes do recipiente, mais polo fornecemento controlado dos reaxentes. Podemos calcular a temperatura máxima dunha chama considerándoa como un medio illado: a reacción faise de maneira adiabática e todo o calor da reacción utilízase para aquecer os produtos.
Calorimetría Adiabática.
[editar]A fin de simplificar a determinación das mudanzas de enerxía ou entalpía, as medicións termoquímicas son, en xeral, conducidas en condicións adiabáticas, por exemplo nun calorímetro adiabático sexa un recipiente que non permite ningunha transferencia de materia e de calor. As medicións son feitas a presión e volume constantes, segundo o esquema:
Dependendo das condicións da operación, a enerxía térmica medida Q corresponde a (volume constante) ou a (presión constante). A etapa de aquecemento pode implicar só os produtos da reacción (combustán nunha chama por exemplo), os produtos e o recipiente (bomba calorimétrica, por exemplo) ou aínda os produtos e un constituinte inerte da mestura( solvente por exemplo).
Entalpía de disolución - Entalpía de atomización
[editar]A entalpía de disociación (chamada ás veces erradamente enerxía de ligazón) é a calor que precisa fornecer para cortar, a presión constante, as ligazóns químicas e separar os átomos. Por definición, o reaxente contendo as ligazóns a cortar é a molécula illada, entón no estado gasoso.
Exemplos: a entalpía da ligazón H-H é a mudanza de entalpía durante a reacción química:
a entalpía da seguinte reacción é igual a 2 entalpías de ligazón O-H:
Poderiamos calcular a entalpía de formación de calquera composto gasoso a partir dunha táboa de entalpía de disociación, Porén, a entalpía de ligazón dunha molécula depende moitas veces do resto da molécula e os dados das táboas son valores medios.
A entalpía de atomización padrón dun elemento é a calor que precisa fornecer a unha presión de 1 bar constante para cortar todas as ligazóns químicas do elemento no seu estado padrón, e formar así os átomos no estado gasoso. Por exemplo, a reacción de atomización da grafite é:

























![{\displaystyle \Delta H(T_{2})\;-\;\Delta H(T_{1})\;=\;\int _{T_{1}}^{T_{2}}\left[c{\bar {C}}_{P}(C)\;+\;d{\bar {C}}_{p}(D)\;a{\bar {C}}_{P}(A)-b{\bar {C}}_{P}(B)\right]dT}](https://wikimedia.org/api/rest_v1/media/math/render/svg/de9d2c16c4fbf9ff1f83b78e80562ab914594307)




